如何预测野生动物带来的下一场传染病大爆发?

科技行者 2月1日 北京消息:
▲ 图:莱尔果蝠(Pteropus lylei),是目前已知的几种能够携带尼帕病毒的蝙蝠之一。研究人员们强调,动物健康与人类健康可谓息息相关。
2013年12月26日,一位名叫Emile Ouamouno的两岁男孩在西非几内亚的Meliandou村突染恶疾。两天里,他开始呕吐,便色发黑,幼小的身体也因高烧不退而扭曲。12月28日,他永远离开了人世。
几周之内,他的姐姐、母亲和祖母纷纷染病,这场疾病最终导致数千人丧生。一场有史以来规模最大的埃博拉疫情,就此开始肆虐。
尽管万分紧急,但研究小组奋战了一个月之久,才逐渐摸清这场流行病的潜在来源:一群安哥拉无尾蝙蝠(Mops condylurus)栖息在离Emile家不到200英尺的空心可乐果树上。当地人把这种蝙蝠称为懒鼠或者飞鼠,它们有着一条长长的尾巴,身上会散发出一种独特的气味。本地儿童特别喜欢鼓捣这些蝙蝠,包括用木棍驱赶它们,甚至把它们烤熟当作零食。
当生态学家及兽医们于2014年4月到达Meliandou村时,这棵树已经被烧毁,蝙蝠们也不知去向。然而,这种尺寸与小鼠相关的有翼哺乳动物仍被视为嫌疑最大的埃博拉病毒潜在寄宿体。换句话说,在该病毒危害人类之前,这群蝙蝠很可能在充当着埃博拉的临时栖息地。
这种疾病带来的毁灭性影响对人类来说并不陌生。在埃博拉之前,SARS、莱姆病、艾滋病以及鼠疫等大多数致命疾病,实际上都源自其他物种。以动物为庇护所,这些病原体会在每一轮大规模流行病之间隐藏身形,等待着下一次全面爆发的机会。
而等到大部分病原体得到确认之时,它们早已扩散到人体中。这时,医护工作者面前只有一条路可走:在人类社会彻底崩溃之前,找到遏制疾病蔓延的有效方法。
对于Cary研究所的疾病生态学家Barbara Han来说,这种被动的反应式方法还远远不够。她表示,“实际上,这意味着只有等到人们已经生病,我们才能发现问题。已经下雨了,再发雨伞还有什么意义呢?下雨之前先行预报才是最好的办法。”
伦敦大学学院疾病生态学家David Redding表示,要想抢先一步,研究人员需要更好的工具,从而在疾病全面爆发之前做出预测。换句话说,研究人员需要从之前的疾病生态与流行病数据当中寻找模式,分析病原体到底是怎样一步步从荒野走向人类社会的。
仅靠人脑,当然无法轻易分辨出大部分此类警示信号。因此,Han以及Redding等多位科学家开始转向计算模型,希望借助机器的力量搜索大量生态与人口统计数据、识别其中的蛛丝马迹,最终揪出下一个可能的传染性疾病发源地。
▲ 图:2014年埃博拉疫情爆发期间,几内亚与利比里亚两国交界处,由于存在频繁的航运及其他形式的跨国旅行活动,导致病毒本体轻松在不同国家之间转移。
回归荒野,静待时机
荒野之中,确实存在着大量对人体有着致命威胁的病原体。长期从事动物生态学研究的Barbara Han,在跟踪两栖动物所携带的真菌病原体方面拥有着丰富的经验。
她注意到,这些病原体,绝不会老老实实地永远待在野生动物体内。
过去几十年以来,疾病控制中心(CDC)曾记录到一系列首次出现的传染病,其中75%属于人畜共患病,也就是能够由动物传播给人类。多年过去,尽管科学家们已经收集到大量关于动物生态体系的数据,但仍然很难摸清不同病原体之间的关键共性——换言之,到底是哪些因素决定某一物种能否将病原体传播给人类。
为了解决这个难题,Han决定开发一款工具,帮助人类研究员完成那些以往根本无法独立解决的大规模工作。几年前,她和她的团队训练出一套计算机模型,能够根据217种确诊患者的共同特征,挑选出具有较高疾病携带能力的新啮齿动物。Han解释道,这套模型的工作原理跟Pandora歌曲推荐技术有点相似:同样是利用一种算法学习趋势——不同于关注音乐品味的Pandora,她的模型更强调易感染性。以此为基础,模型就能给出以往未被纳入考量的歌手,或者动物。通过这种方式,Han的模型先后扫描了全球2277种啮齿动物,发现了58种此前未被归入任何潜在携带者目录的物种。
Han整理出的新目录极为丰富,涵盖了啮齿动物中的大部分谱系。虽然范围极广,但这些动物之间确实有着一些共同之处,例如寿命较短,性早熟,且繁殖能力极强。Han解释道,“这些啮齿动物的生命周期基本可以用「快生、快死」来形容。”她指出,这类动物往往优先考虑大量繁殖,身体构造也更多强调生殖系统——而非免疫系统。这种特性导致此类动物不会被致命病原体“灭族”;但在另一方面,寿命更长且发育缓慢的人类,则会受到病原体的毁灭性影响。
▲ 图:一种北部蚱蜢鼠(Onychomys leucogaster),它是机器学习模型精确定位的几种病原体携带者之一。该模型经过训练,能够检测到具有疾病传播风险的啮齿动物。
当然,预测只能作为参考,未必代表绝对事实。而且不少可能携带疾病的物种,身上也许根本就没有相关病原体。但是,疾病预防控制中心高级病原学与病理学研究室主任Inger Damon表示,“如果处理得当,这种建模研究方式能够有效提供高质量假设,而且也确实证明了以往曾经发生过的情况。”
Han表示,在某些特定情况下,这类模型能够发挥巨大作用。在筹备相关论文时,她的团队发现,计算机列出的两只田鼠身上确实存在寄生虫。
同样的情况在其他动物种群中也得到了验证。2016年,Han和她的同事们发布了一份清单(详见:https://journals.plos.org/plosntds/article?id=10.1371/journal.pntd.0004815),其中列出可能感染丝状病毒(包括埃博拉病毒)的蝙蝠物种。不到一年之后,就有一组研究人员从中国果蝠身上发现了潜伏的丝状病毒,证实了Han论文中的观点。
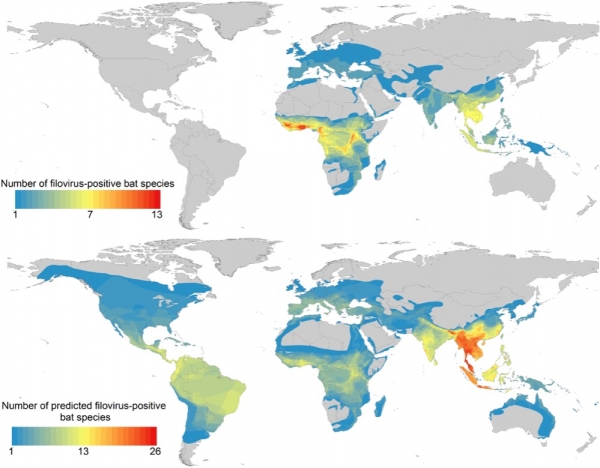
▲ 图:已知和预测的丝状病毒阳性蝙蝠物种的范围图。如图所示,21种经检测呈丝状病毒阳性的蝙蝠范围图(上);通过广义增强回归分析(generalized boosted regression analysis)预测,90%携带丝状病毒阳性的其他蝙蝠物种的范围图(下)。【《Undiscovered Bat Hosts of Filoviruses》(2016年)/图片来源】
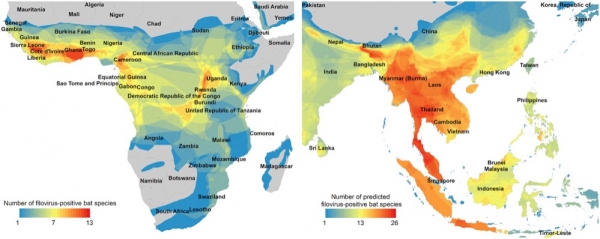
▲ 图:放大已知和预测的丝状病毒阳性蝙蝠物种的范围图。如图所示,撒哈拉以南非洲的丝状病毒阳性蝙蝠物种热点放大图(左);预测出的来自东南亚的丝状病毒新携带者热点放大图(右)。【《Undiscovered Bat Hosts of Filoviruses》(2016年)/图片来源】
几乎在同一时间,来自哥伦比亚大学的一位同事兴奋地打电话给Han,表示他在塞拉利昂发现了一种新型埃博拉病毒。目前尚不清楚这种病毒是否会影响到人类,但他已经在两种蝙蝠体内发现这种病毒。其中之一正是安哥拉无尾蝙蝠,也就是Han纳入新目录的物种。当初被怀疑感染小男孩Emile Ouamouno的,正是这种蝙蝠。
弥合鸿沟
当然,只有拥有指导意义的清单才是好清单。接下来的重要一步,就是弄清楚,疾病到底是怎样从被感染动物体内跑到人身上去的。
在伦敦大学学院,David Redding携手生态学家Kate Jones,利用自己的一套计算方法来跟踪这类跨物种感染活动的过程。Redding将其称为混合方法,他们发现的最新模型已经被发表在《自然-通讯》上(详见:https://www.nature.com/articles/s41467-019-12499-6)。该模型从生态学和流行病学两方面,来预测埃博拉病毒在非洲蔓延和随后爆发的高风险地区。
他解释道,“我们都知道动物宿主在哪里。(以埃博拉病毒为例,除了蝙蝠之外,大猩猩和麂羚也是可能的携带者。)”“此外,我们也很清楚人类分布在哪里。如果二者同时在某个地区活动,那么就可能发生接触以及病原体传染。”
这听起来简单,但Redding强调称,众多其他变量导致疾病蔓延变得非常难以判断。举例来说,土地利用可能对传染范围以及影响到的具体人口数量产生巨大影响。而从人类的角度出发,疾病爆发的实际规模则取决于人际关系(人们四处往来以及与他人对接的难易度)以及地区经济状况,后者往往直接决定当地能够分配到医疗保健领域的资金数额。
从病毒的角度来看,Redding表示“最理想的传播途径当然:人口众多,且大规模居住在森林中,与动物宿主毗邻。此外,当地要靠近大型交通枢纽,靠近大城市。只要能选到这样的「风水宝地」,疫情的大规模爆发将只是时间问题。”
Damon补充道,以上都是影响人畜共患病传播的关键性变量,但绝不是全部变量。事实上,只有一部分病原体外溢造成了疾病流行。在她看来,Redding提出的模型。可能未能覆盖到所有与病原体传播相关的人类行为——例如,庞大的葬礼传统可能增加人们与被感染者之间的接触机率。
佛罗里达大学疾病生态学家Sadie Ryan表示,根据定义,计算建模永远只能是一种对事实进行简化的产物。程序必须要利用有限的数据集准确高效地捕捉现实世界中的复杂性因素。她强调,这是一项巨大的挑战,而且其中蕴藏着极高的风险。“如果在没有真实信息的情况下进行大规模空间计算模拟,那么我们做的就不能叫科研,只能算是在制作模拟游戏。”
但Ryan也承认,目前已有的这些模型(考虑到动物、人类以及环境等因素)确实能够比较有效地捕捉到“疾病传播事件中的现实生物学特征。”
▲ 图:2013年埃博拉疫情的爆发原点,很可能就是安哥拉无尾蝙蝠将病毒传染给西非几内亚Meliandou村的孩子们。该村的儿童经常用棍棒驱赶树洞中的蝙蝠,甚至捉来当作零食。
在目前的迭代当中,Redding提出的模型已经拥有令人信服的出色表现。根据所提供的数据,它可以正确识别出几个确实经历过埃博拉疫情的地区——包括刚果民主共和国、加蓬以及受Meliandou村疫情影响的其他西非地区。
这套模型的首次模拟于2018年开始运行,结果是其他几个地区——包括尼日利亚、加纳、卢旺达以及肯尼亚等尚未被病毒感染的国家——也被列入高发清单。就在几个月之后,模型就刚果民主共和国做出的两项疫情预测得到证实。
气候变化与疾病传播存在相关性
西非的埃博拉疫情于2016年6月全面结束。这时已是Meliandou村的Emile Ouamouno患病两年半之后,至少有28646人被感染,至少11323人死亡——这一数字,超过了以往所有埃博拉疫情的总和。
如今,埃博拉病毒已经重新出现。Redding表示,由于荒野之中存在诸多藏身之所,这种致命病原体可能终有一天还会再次袭来。
Han指出,疾病爆发预测的意义也正在于此。在她看来,AI模型能够指导人们提前对医疗资源进行转移,或者指导生态学家与环保主义者保护并监测可能携带病原体的野外物种。
Damon则强调,利用模型生成结论是一码事,根据这些结论采取行动又是另一码事。预测蔓延与防止蔓延之间存在巨大差异——后者要求增加监控过程,同时提供大量资源,从而在疫情刚刚出现之时就马上出手遏制。
▲ 图:感染控制主任(图左)在几内亚N'Zérékoré的一家小型诊所内,现场展示如何正确洗手。
Ryan表示,整个世界的变化速度正在加快,因此任何干预措施的执行也将越来越复杂。随着气温升高以及物种自然栖息地的消失,可能携带病原体的物种将被迫迁徙并前往完全陌生的生存环境。这一切,都将改变疾病的传播路径。Han指出,“气候变化实际上会对地球上的一切造成影响。”目前,她正在与美国宇航局的研究人员合作,着手将气候数据纳入该团队的预测模型当中。
Redding也提到,就埃博拉病毒而言,这种趋势已经非常明确:气候变化越严重,爆发的疾病就越多。根据模拟结果,预计到2070年,由于环境将更温暖且更潮湿,整个非洲大陆的疾病外流风险将进一步提高。Redding表示,人类可以通过减少碳排放以及增加发展可持续性等方式,缓解其中部分影响因素,但前提是,整个世界必须尽快行动起来。
Ryan总结道,“这就是我们提出的提前干预概念。如果未来疾病蔓延,那我们必须得及早出手阻止。做好准备,挑战就在眼前。”
好文章,需要你的鼓励
-
Queen's大学重磅研究:程序员的角色即将彻底改变,从码农到智能体指挥官
Queen's大学研究团队提出结构化智能体软件工程框架SASE,重新定义人机协作模式。该框架将程序员角色从代码编写者转变为AI团队指挥者,建立双向咨询机制和标准化文档系统,解决AI编程中的质量控制难题,为软件工程向智能化协作时代转型提供系统性解决方案。
-
医疗AI的"显微镜革命":西北工业大学团队发布首个超声影像专用智能助手EchoVLM
西北工业大学与中山大学合作开发了首个超声专用AI视觉语言模型EchoVLM,通过收集15家医院20万病例和147万超声图像,采用专家混合架构,实现了比通用AI模型准确率提升10分以上的突破。该系统能自动生成超声报告、进行诊断分析和回答专业问题,为医生提供智能辅助,推动医疗AI向专业化发展。
-
上海AI实验室突破自回归图像生成瓶颈:ST-AR让AI"先理解再创造"
上海AI实验室团队发现自回归图像生成模型存在局部依赖、语义不一致和空间不变性缺失三大问题,提出ST-AR训练方法。该方法通过掩码注意力、跨步骤对比学习和跨视角对比学习,让AI"先理解再生成"。实验显示,ST-AR将LlamaGen模型的图像理解准确率提升一倍以上,图像生成质量提升42-49%,为构建更智能的多模态AI系统开辟新路径。